I. Tujuan
- Mengetahui kelarutan dan stabilitas garam klorida
- Mempelajari pembentukan kompleks logam transisi dengan ion klorida
II. Dasar Teori
Unsur-unsur halogen dapat diidentifikasi warn adan sifatnya. Misalnya Cl: berupa gas kuning kehijauan pada suhu kamar, non-polar, kelarutan dalam air kecil dan larut dalam pelarut non-polar.
Semua halogen dapat mengoksidasi air menjadi gas O2 dan bukan merupakan oksidator kuat. Larutan halogen tidak stabil karena cenderung mengalami auto-oksidasi atau auto-reduksi, proses ini disebut disporposionasi:
2 Cl2(aq) + 2 H2O HClO(aq) + 2HCl(aq)
Pada reaksi tersebut Cl2 mengalami reaksi reduksi dan reaksi oksidasi. Pemutih klorin (bleaching agent) mengandung larutan hipoklorit (NaOCl). Ion ClO merupakan suatu oksidator, daya oksidasinya sama dengan klorin namun ion ClO berbeda dengan Cl-sebab asam hipoklorit, HclO adalah asam lemah dan ion ClO- adalah basa yang cukup kuat.
Klor digunakan secara luas dalam pembuatan banyak produk sehari-hari. Klor digunakan untuk menghasilkan air minum yang aman hampir diseluruh dunia. Bahkan, kemasan air terkecilpun sudah terklorinasi.
Klor digunakan secara luas dalam pembuatan banyak produk sehari-hari. Klor digunakan untuk menghasilkan air minum yang aman hampir diseluruh dunia. Bahkan, kemasan air terkecilpun sudah terklorinasi.
Klor juga digunakan secara besar-besaran pada proses pembuatan kertas, zat pewarna, tekstil, produk olahan minyak bumi, obat-obatan, antiseptik, intektisida, makanan, pelarut, cat, plastik, dan banyak produk lainnya.
Ion klorida membentuk endapan dengan ion-ion Ag+, Pb+, dan Hg+ berperan sebagai igan dalam pembentukan kompleks yang diambil melalui perubahan warna dan melarutnya endapan atau padatan.
Kebanyakan klor diproduksi untuk digunakan dalam pembuatan senyawa klorin untuk sanitasi, pemutihan kertas, desinfektan dan proses tekstil. Lebih jauh lagi, klor digunakan untuk pembuatan klorat, kloroform, karbon tetrakorida dan ekstraksi brom.
Pemutih klorin (bleaching agent) mengandung larutan hipoklorit (NaOCl), ion ClO-merupakan suatu oksidator, daya oksidasinya sama dengan klorin namun ion ClO-berbeda dengan Cl‑ sebab asam hipoklorit, HclO adalah asam lemah dan ion ClO- adalah basa yang cukup kuat, sedangkan Cl- mempunyai sifat netral dan merupakan basa konjugasi dari HCl kuat. Ion klorida membentuk endapan dengan ion-ion Ag+, Pb+, dan Hg+, berperan sebagai ligan dalam pembentuka kompleks yang diamati melalui perubahan warna dan melarutnya endapan atau padatan.
III. Alat dan Bahan
Alat
- Pipet tetes
- Rak tabung reaksi
- Gelas ukur
- Tabung reaksi
Bahan
- NaCl 0,1 M
- AgNO3 0,1 M
- NH3 6M
- CuSO4 0,1 M
- Lakmus merah biru
- NaOCl 5% ( baycline)
- NaOH 6 M
- KI 0,1 M
- KBr 0,1 M
- n-heksana atau petroleum eter
- HCl pekat
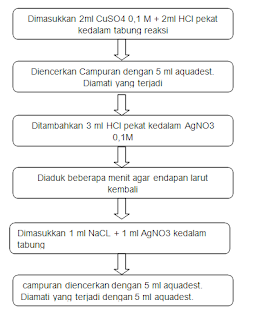
IV. Cara Kerja
1 ion Klorida (Cl-)
a. Kelarutan dan kestabilan garam klorida
2. Ion Hipoklorit (ClO-)
a. Reaksi Lakmus
b. Reaksi dengan AgNO3
c. Daya Oksidasi
V. Hasil Pengamatan
1. Ion
Klor (Cl-)
a. Kelarutan
dan Stabilitas garam klorida
I. NaCl
+ AgNO3 à ↓ AgCl + NaNO3,
terbentuk endapan putih AgCl
II. I
+ NH3 à terbentuk endapan putih dengan larutan
jernih
III. II
+ HNO3 à terbentuk endapan putih dengan reaksi
eksoterm (panas)
b. Kompleks
logam transisi dengan ion Cl-
I. CuSO4
+ HCl à tidak terbentuk endapan (larut), larutan berwarna hijau terjadi reaksi eksoterm
II. I
+ H2O à Warna hijau lebih muda dari larutan
sebelumnya dan agak bening
III. AgNO3
+ HCl à ↓ AgCl + HNO3, terbentuk endapan putih AgCl larutannya berwarna kuning terjadi reaksi
eksoterm
IV. III
+ H2O à terbentuk endapan putih, larutan
berwarna putih
2. Ion
Hipoklorit (ClO-)
a. Lakmus
I. NaClO
+ lakmus merah à lakmus berubah warna menjadi biru
kemudian menjadi putih
II. NaClO
+ lakmus biru à lakmus biru tetap biru kemudian berubah menjadi putih
b. Reaksi
dengan AgNO3
I. NaOCl
+ AgNO3 à terbentuk endapan putih
II. I
+ HNO3 à terbentuk gas warna larutan kuning
dengan endapan berwarna putih
III. NaOH
+ AgNO3 à terbentuk endapan coklat tua
IV. III
+ HNO3 à tidak larut, menghasilkan panas, lebih
panas dari percobaan NaOCl + AgNO3 dan HNO3, larutannya
bening terbentuk endapan coklat tua
c. Daya
Oksidasi Ion ClO-
I. KI
+ C6H12 + NaOCl à terdapat 2 fase
yang berwarna merah muda dan orange
II. KBr
+ C6H12 + NaOCl à terdapat 2 fase
yang berwarna putih kedua-duanya
III. I
+ HCl à terbentuk
menjadi 3 fase dengan warna ungu, orange dan coklat
IV. II
+ HCl à terbentuk 2 fase dengan warna kuning muda dan kuning tua
VI. Pembahasan
Pada
percobaan ini dilakukan pengujian sifat – sifat dari senyawa klor.
Bahan-bahan yang digunakan adalah NaCl, NaOCl, dan HCl sebagai sampel. Pada
percobaan pertama, praktikan mereaksikan NaCl dengan AgNO3 yang
menghasilkan reaksi pengendapan. Endapan yang terbentuk berwarna putih dan
mengumpal. Endapan yang muncul adalah senyawa AgCl yang merupakan hasil reaksi.
Perak klorida memiliki nilai kelarutan yang kecil, oleh karena itu terbentuklah
endapan. Dapat dituliskan persamaan reaksinya adalah
2NaCl(aq) + Ag2SO4(aq) → Na2SO4(aq)
+ ↓2AgCl
Setelah itu endapan AgCl ditambahkan
lagi dengan larutan basa NH3 6M namun endapan tidak larut. Maka persamaan reaksinya
adalah
AgCl + NH4OH → NH4Cl + ↓ AgOH
kemudian
ditambahkan larutan HNO3 kemudian terbentuk suatu gas atau uap
dan larutannya menjadi bening kembali serta terbentuk endapan putih kembali.
Dengan persamaan reaksinya :
AgCl + HNO3 → HCl + ↓ AgNO3
Dari hasil percobaan ini dapat disimpulkan bahwa
endapan berasal ion Ag+ dan Cl- sukar larut jika ditambahkan dengan larutan asam
atau pun basa maka dari itu garam klorida memilik stabilitas untuk
mempertahankan endapan yang baik
1. Tuliskan contoh-contoh
senyawa klor dengan bilangan oksidasi Cl (-1, 0, +1, +3, +4, +5, +7) dan
sebutkan kegunaannya kalau ada?
2. Bagaimana cara membuat larutan pemutih NaClO secara komersial. Tuliskan reaksinya !
3. Bagaimana cara zat pemutih dapat membuat pakaian kelihatan lebih putih?Zat pemutih bekerja dengan dua cara, yaitu :
Pada percobaan yang kedua adalah percobaan mengenai pembentukan
kompleks logam transisi dengan ion Cl-. Ion kompleks memiliki ion
logam dengan jumlah tertentu molekul-molekul atau ion-ion yang mengelilinginya. Percobaan ini mereaksikan tembaga sulfat (CuSO4)
dengan asam klorida (HCl) yang menghasilkan larutan berwarna hijau muda. .Hal ini disebabkan karena CuSO4 sendiri dapat
bereaksi dengan HCl membentuk asam sulfat dan tembaga diklorida sebagai hasil
sampingnya. Asam sulfat inilah yang menyebabkan warna berubah menjadi kehijauan.Ketika diencerkan dengan 5 ml H2O larutan kembali
berwana hijau muda lagi. Hal ini disebabkan
ketika asam sulfat dan tembaga diklorida ditambahkan dengan aquadest dapat
membentuk tembaga sulfat kembali dengan asam klorida dan molekul air sebagai
produk sampingnya.Sedangkan pencampuran AgNO3 dengan HCl
terbentuk endapan putih AgCl yang tidak larut dengan penambahan
HCl. Persamaan reaksi
AgNO3 + HCl è AgCl↓ + HNO3
Percobaan ketiga, praktikan melakukan percobaan
Natrium hipoklorit (NaClO) terhadap lakmus, AgNO3 dan
memerhatikan daya oksidasi ClO- . Berdasarkan hasil
pengamatan, kertas lakmus merah berubah menjadi warna biru dan kertas lakmus
biru tetap menjadi warna biru. Hal ini menunjukkan bahwa NaClO bersifat basa.
Selanjutnya mereaksikan NaClO dengan AgNO3 yang menunjukkan
perbedaan terhadap reaksi NaCl dengan AgNO3. Reaksi NaClO dengan
AgNO3 menghasilkan endapan putih tetapi ketika ditambahi HNO3 masih
terbentuk endapan dan larutannya bening kekuning-kuningan, sedangkan endapan
pada reaksi NaCl dengan AgNO3 yang ditambahkan HNO3 larut.
Hal ini disebabkan pada Reaksi NaClO dengan AgNO3 endapannya
tetap terbentuk karena adanya asam nitrat.serta reaksi NaClO dengan AgNO3
berlangsung secara eksoterm karena pada dinding tabung reaksi terasa panas dan
terdapat gelembung gas. Gas yang terbentuk adalah gas oksigen dari reaksi AgNO3 dengan
NaOCl. Lalu tabung yang berisikan NaOH, direaksikan dengan AgNO3 terbentuk
endapan coklat dengan warna larutan bening dan setelah direaksikan dengan HNO3 endapan
menjadi coklat tua dengan disertai dengan bertambahanya suhu larutan. (lebih panas dari percobaan NaOCl + AgNO3dan HNO3)
Dengan persamaan berikut :
2NaOCl + 2AgNO3 → 2AgCl↓ + 2NaNO3 + O2
2HNO3 + NaOCl + AgNO3 → AgCl + NaNO3 + H2O
NaOH + AgNO3 → AgOH + NaNO3
Pada percobaan terakhir adalah daya oksidasi ion ClO- ,
percobaan ini mereaksikan 2 ml larutan kalium iodida (KI), 1 ml n-heksana (C6H12)
dan larutan NaClO yang menghasilkan larutan yang terdiri dari 2 fase
yang berwarna merah muda dan orange. Ketika diasamkan
dengan larutan HCl, larutan berubah menjadi bentuk 3 fase dengan warna ungu, orange dan coklat. Kemudian, praktikan mereaksikan 2 ml larutan kalium bromide (KBr), 1 ml
n-heksana (C6H12) dan larutan NaClO yang menghasilkan
larutan berwarna putih. Ketika diasamkan dengan larutan HCl, larutan berubah bentuk menjadi 2 fase dengan warna kuning muda
dan kuning tua. Hal ini menunjukkan bahwa Natrium
hipoklorit mampu mereduksi iod dalam senyawa kalium iodida yang ditunjukan pada
perubahan warna pada larutan n-heksana dengan kalium iodida. Hal ini disebabkan
karena bilangan oksidasi klor dalam senyawa natriun hipoklorit
paling kecil sehingga ia memiliki daya oksidator yang kuat.
VII. Kesimpulan
- Kelarutan senyawa klorida yaitu perak klorida yang terbentuk sangat kecil dan stabil.
- Ion klorida mampu membentuk ion kompleks dengan tembaga
- Pembentukan logam kompleks klor ditandai dengan perubahan warna.
- Senyawa klor memiliki daya oksidasi yang kuat
- Natrium Hipoklorit (NaOCl) bersifat basa.
- Pembentukan perbedaan lapisan dalam larutan hasil reaksi disebabkan oleh perbedaan kepolaran, dan berat jenis kepolaran
Oxtoby, D. W., Gillis,
H. P. dan Nachtrieb, N. H., 1999. Kimia Modern. Jakarta
: Erlangga
Vogel. 1985. Analisis
Anorganik Kualitatif Makro dan Semimikro Jilid 1. Jakarta : Kalman
Media
Pusaka.
Vogel. 1985. Analisis
Anorganik Kualitatif Makro dan Semimikro Jilid 2. Jakarta : Kalman
Media
Pusaka.
http://www.chem-is-try.org/materi_kimia/kimia_anorganik1/logam_transisi/tembaga-anorganik/ "diakses 20 Oktober 2012"
IX. Lampiran
Biloks
|
Senyawa klor
|
Kegunaan
|
-1
|
NaCl
|
sebagai bahan pengamat dan bahan campuran
|
0
|
Cl2
|
sebagai senjata perang pada perang dunia II
|
+1
|
NaOCl
|
sebagai pemutih pakaian
|
+3
|
NaClO2
|
sebagai pemutih dlam industri tekstil dan kertas
|
digunakan pada pengolahan air sebagai desinfektan
| ||
terdapat pada obat kumur dan pasta gigi
| ||
+4
|
NaClO3
|
sebagai herbisida
|
+5
|
NH4ClO4
|
sebagai campuran bahan bakar roket
|
+7
|
HClO4
|
Sebagai bahan desinfektan
|
Larutan pemutih dapat dibuat dengan mereaksikan NaOH dengan gas klor (Cl2), gas klor dilewatkan kedalam larutan dingin NaOH encer pada suhu dibawah 40º C, jika suhu lebih dari 40 oC maka akan membentuk natrium klorat (NaClO3)
2NaOH + Cl2 → NaCl + NaOCl + H2O
a. Mengubah molekul menjadi zat yang tidak mengandung kromofor atau masih mengandung kromofor yang tidak menyerap cahaya visible dengan cara memutuskan ikatan kimia kromofor oleh pemutih yang bersifat oksidator.
b. Mengubah ikatan rangkap pada kromofor menjadi ikatan tunggal oleh pemutih yang bersifat rediktor. Pemutusan ikatan rangkap ini dapat mengurangi kemampuan kromofor menyerap sinar visible.